1. 전기 화학 반응
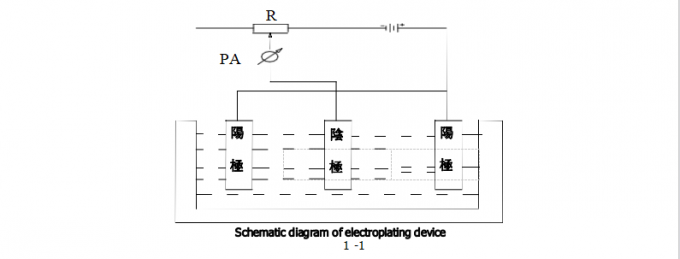
아래의 그림은 전기 도금 장치의 계통도입니다. 도금처리될 부품은 음극이며, 그것이 DC 전력 공급 장치의 음극에 연결됩니다. 금속 애노드는 DC 전력 공급 장치의 양극에 연결됩니다. 둘다 음극과 음극은 플로팅 솔루션에 몰입합니다. 어떤 잠재성이 음극과 음극 사이에 적용될 때, 다음의 반응은 음극에서 발생합니다 : Mn+가 플로팅 솔루션의 내부에서 전극과 플로팅 솔루션 사이의 인터페이스까지 퍼뜨린 금속 이온은 음극으로부터 N 전자를 얻고, 다른 한편 금속 M로 감소하고, 음극에 그리고 나서 음극에 완전히 정반대 반응이 발생합니다 즉, 금속 M의 해소가 음극 인터페이스에서 발생하고, N 전자가 금속 이온 Mn+를 발생시키기 위해 공개됩니다.
2. 패러데이의 법칙
경향이 플로팅 솔루션을 통과할 때, 전해질 반응은 전해질 용액에서 발생합니다, 음극 위의 금속이 끊임없이 촉진되고 애노드 메탈이 끊임없이 해산됩니다. 그러므로, 금속의 강수량 (또는 해소는) 통과하는 요금과 관련되어야 합니다. 수많은 실험 결과를 기반으로, 패러데이는 침전된 (또는 해산되) 물질과 전하 사이에 관계의 법을 세웠습니다.
파라의 제일 법칙 : 전극 위의 중량의 침전된 (또는 해산되) 물질은 전해질 반응 동안 지나간 요금에 비례합니다, 그것이 다음과 같습니다 : m=kQ=kIt (M 전극 위의 다량의 침전된 분해되는 재료입니다 ; 큐는 통과된 요금입니다 다음과 같은 경우에서 ; K는 비례 상수입니다 ; 나는 경향입니다 ; T는 전화 시간입니다.
패러데이의 두번째 법률 : 다른 전해액에, 같은 액수의 요금이 통과되고, 전극에 촉진시키는 (또는 용암) 물질의 양이 똑같고, (또는 소실되) 어떠한 물질의 1 mol을 촉진시키도록 요구된 요금의 양이 충분한 때 그것은 9.65X104C입니다. 이 상수는 페러데이 상수로 불리고, F, K=M/F에 의해 대표됩니다.
3. 전류 효율
전기 도금 동안, 실제로 음극위에 침전된 다량의 물질은 파라의 법에 따라 획득된 계산 결과와 동일하지 않고 실제 밸브가 항상 계산된 값보다 작습니다. 이것은 전극 위의 한 반응 이상이 있기 때문입니다. 주반응 뿐 아니라 부반응은 또한 발생합니다.
4. 플로팅 솔루션의 분산능
플로팅 솔루션의 분산능은 고르게 또한 던지는 능력으로 알려진 금속층의 두께를 분배하기 위해 전기 도금액의 능력을 언급합니다. 전기 도금액의 잘 분산능, 더 획일적인 다른 캐소드 부에 놓아진 금속층의 두께.
5. 플로팅 솔루션의 적용 범위
전기 도금하는 생산에, 일반적으로 사용된 또 다른 개념은 메탈 코팅을 도금 부품의 깊은 리세스에 맡기기 위해 전기 도금액의 능력을 참조하는 또한 깊은 도금 능력으로 알려진 커버리지성입니다. 분산능과 포함 능력은 다릅니다. 전자는 어떻게 금속이 인 유니폼이 음극의 표면 상에 분배했는지 질문입니다. 그것의 전제는 음극의 표면적으로 코팅이 있다는 것입니다 ; 후자가 금속이 음극 표면의 깊은 리세스에 놓아지는지의 문제를 언급하는 동안.

 귀하의 메시지는 20-3,000 자 사이 여야합니다!
귀하의 메시지는 20-3,000 자 사이 여야합니다! 이메일을 확인하십시오!
이메일을 확인하십시오!  귀하의 메시지는 20-3,000 자 사이 여야합니다!
귀하의 메시지는 20-3,000 자 사이 여야합니다! 이메일을 확인하십시오!
이메일을 확인하십시오! 

